Мир химии - это мир невидимых процессов и взаимодействий, которые определяют многое в нашей жизни. Реакция веществ на изменение факторов - одна из ключевых тем в химии, которая позволяет нам понять, как и почему происходят различные химические переходы.
Изменение факторов, таких как температура, концентрация, давление или наличие катализатора, может существенно влиять на скорость и направление химических реакций. Некоторые реакции, например, обратимые реакции, могут быть "ускорены" повышением температуры, в то время как другие могут протекать только при строго заданных условиях.
Факторы окружающей среды играют особую роль в процессе взаимодействия веществ. Они могут способствовать или, наоборот, затруднять связь между атомами и молекулами. Например, изменение концентрации реагентов может привести к более интенсивному столкновению частиц и увеличению вероятности коллизий, что в свою очередь ускоряет реакцию.
Понимание взаимосвязи между изменением факторов и реакцией веществ помогает химикам контролировать и оптимизировать процессы. Знание, как и почему реакции происходят или не происходят, позволяет проводить сложные синтезы и создавать новые материалы, которые находят применение в множестве областей, начиная от фармацевтики и электроники, и кончая альтернативными источниками энергии.
Факторы, влияющие на реакцию веществ в химии

В химии реакция вещества зависит от множества факторов, которые могут влиять на скорость и результат реакции. Эти факторы могут быть разделены на две основные группы: химические и физические.
Химические факторы:
1. Концентрация вещества – чем выше концентрация, тем быстрее протекает реакция.
2. Температура – повышение температуры обычно увеличивает скорость реакции, поскольку это увеличивает энергию частиц вещества и частоту их столкновений.
3. Физическая форма – реакция может быть быстрее при использовании мелко измельченных частиц, так как это увеличивает поверхность контакта.
4. Соотношение компонентов – присутствие или отсутствие определенных веществ может повысить или замедлить реакцию.
Физические факторы:
1. Размер реакционной ёмкости – масштаб реакции может влиять на ее результат.
2. Давление – изменение давления может изменить скорость реакции, особенно в газовых системах.
3. Растворитель – выбор растворителя может повлиять на реакцию.
Понимание этих факторов позволяет ученым и инженерам контролировать и оптимизировать реакции в химии для достижения желаемых результатов и повышения эффективности процессов.
Температура вещества и скорость химической реакции

При повышении температуры, энергия частиц вещества увеличивается, что приводит к более интенсивному движению молекул. Более активное движение молекул повышает частоту столкновений между ними, что, в свою очередь, способствует увеличению числа успешных столкновений - тех, которые приводят к образованию продуктов реакции.
Также повышение температуры может способствовать изменению энергии активации химической реакции. Энергия активации - это минимальная энергия, которую частицы вещества должны иметь для того, чтобы преодолеть барьер реакции и начать взаимодействие. Увеличение температуры может уменьшить энергию активации, что делает процесс более благоприятным и увеличивает скорость реакции.
| Температура вещества | Скорость реакции |
|---|---|
| Понижение | Замедление |
| Повышение | Ускорение |
Однако, следует отметить, что при слишком высоких температурах некоторые реакции могут протекать нежелательными путями, что может привести к образованию побочных продуктов или даже разрушению исходных веществ.
Температура вещества является одним из ключевых факторов, которые химики учитывают при изучении и оптимизации химических процессов. Изменение температуры может значительно влиять на скорость реакции и ее результат.
Влияние поверхности вещества на реакцию

Поверхность вещества играет важную роль в химических реакциях. Она определяет количество активных центров, доступных для взаимодействия с реагентами и ускорения химической реакции. Чем больше активных центров поверхности вещества, тем быстрее протекает реакция.
Увеличение поверхности вещества может быть достигнуто различными способами. Одним из них является измельчение вещества. Чем мельче частицы вещества, тем больше поверхность и больше возможности для реагирования с другими веществами. Например, крупные куски металла реагируют медленнее с кислородом, чем тонкий порошок металла.
Также поверхность вещества может быть увеличена за счет создания пористой структуры. Пористые материалы имеют много маленьких отверстий и каналов, что способствует увеличению активных центров поверхности и ускоряет химическую реакцию. Примером таких материалов являются катализаторы, которые используются для ускорения химических процессов в промышленности.
Один из примеров, демонстрирующих влияние поверхности вещества на реакцию, является сгорание древесных материалов. Когда лес рубят и разрушают его структуру, поверхность древесины увеличивается, что увеличивает скорость горения. Таким образом, поверхность вещества может влиять на скорость реакции и тип происходящих химических процессов.
Роль концентрации вещества в химической реакции
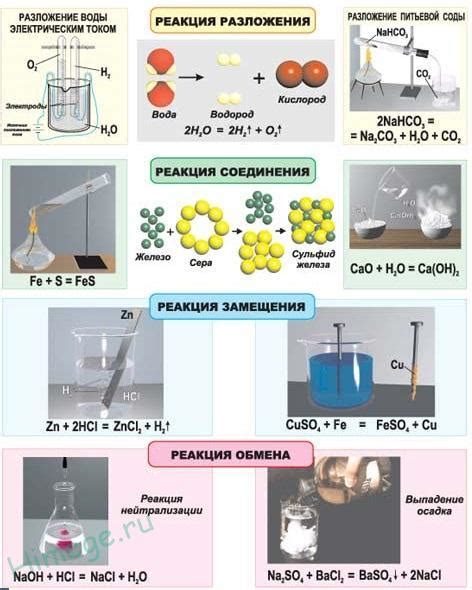
Концентрация вещества играет важную роль в химической реакции. Она определяет количество вещества, содержащегося в единице объема или массы. Изменение концентрации может оказывать значительное влияние на скорость и направленность реакции.
Повышение концентрации реагентов обычно приводит к увеличению скорости химической реакции. Это связано с тем, что повышение концентрации увеличивает количество реагирующих частиц, что в свою очередь увеличивает вероятность столкновения и, следовательно, вероятность образования продукта реакции. Кинетическая теория газов утверждает, что скорость реакции пропорциональна концентрации реагентов в некоторой степени.
Также изменение концентрации может повлиять на равновесие химической реакции. В системах находящихся в равновесии, изменение концентрации одного из реагентов или продуктов реакции может сдвинуть равновесие в направлении обратной реакции или прямой реакции. Если концентрация одного из реагентов увеличивается, то в соответствии со принципом Ле Шателье система стремится смещаться в сторону образования продуктов реакции.
Исследование и изменение концентрации вещества является одной из основных методик в химических исследованиях. Изучение зависимости концентрации реагентов от времени позволяет определить скорость химической реакции и ее механизм. Кроме того, изменение концентрации может использоваться для контроля химических процессов и оптимизации промышленных производств.
Воздействие катализаторов на химическую реакцию

Одной из основных функций катализаторов является снижение энергии активации для химической реакции. Они предоставляют альтернативные пути для образования промежуточных химических соединений с более низкой энергией активации, что позволяет реакции происходить быстрее.
Помимо этого, катализаторы также способствуют увеличению количества эффективных столкновений между реагирующими молекулами, облегчая формирование комплексов реакций. Они также могут изменять электронную структуру реагирующих молекул и стабилизировать переходные состояния реакции.
Катализаторы могут быть использованы для снижения температуры или давления, необходимых для проведения реакции, что может быть важно из экономической и экологической точек зрения. Они также позволяют проводить реакции в более мягких условиях, что может способствовать сохранению качества продукта и повышению его выборочности.
Иногда катализаторы являются переходными металлами или специфическими молекулами, которые способны взаимодействовать с реагентами и образовывать промежуточные комплексы. Другие катализаторы могут быть природным происхождением, таким как ферменты, которые играют ключевую роль в биохимических процессах.
Катализаторы могут быть использованы в различных областях химии, включая органическую, неорганическую, физическую и биологическую химию. Они являются важным инструментом в синтезе новых соединений, производстве химических продуктов и многих других областях химической промышленности.
Влияние давления на протекание химической реакции
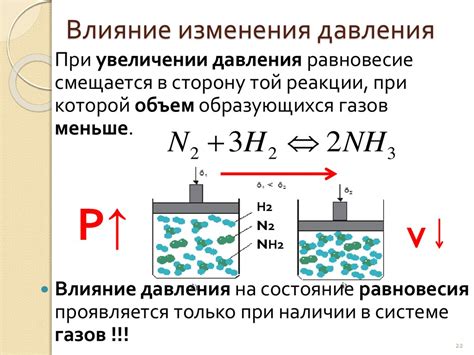
В газовой фазе химическая реакция происходит между молекулами газовых веществ. Изменение давления можно регулировать с помощью сжатия или расширения газа. Повышение давления уменьшает объем газа и увеличивает концентрацию молекул, что способствует более частым столкновениям и, следовательно, увеличению скорости реакции. Увеличение давления также может увеличить степень реакции, если в реакции участвует сжимаемый газ.
В жидкой и твердой фазах изменение давления оказывает меньшее влияние на химическую реакцию. В этих состояниях вещества обладают малой сжимаемостью, поэтому изменение давления приводит к незначительному изменению концентрации молекул. Однако, в некоторых случаях давление может оказывать влияние на их способность взаимодействовать и протекание реакции.



