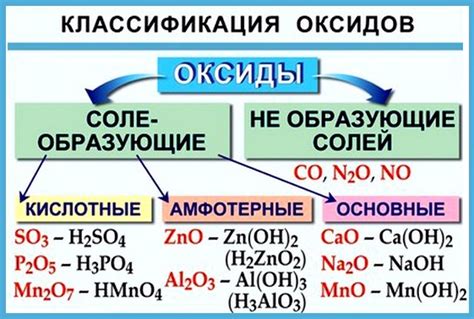
Основные оксиды в химии - это соединения элементов с кислородом, которые способны образовывать щелочные растворы при взаимодействии с водой. Они имеют важное значение не только в химической промышленности, но и в жизни обычного человека.
Основные оксиды характеризуются щелочными свойствами, так как они реагируют с водой, образуя гидроксиды щелочных металлов. Этот процесс, называемый гидратацией, сопровождается выделением большого количества тепла и образованием щелочного раствора с высоким значениями pH.
Одной из важнейших характеристик основных оксидов является основность - способность щелочных растворов нейтрализовать кислоты. Благодаря этому свойству, основные оксиды находят широкое применение в производстве различных продуктов, таких как стекло, керамика, мыло и многие другие насущные предметы повседневной жизни.
Основные оксиды в химии: определение и свойства
Основные оксиды обычно образуются при реакции металлического элемента с кислородом. В результате этой реакции образуется структура, в которой металлический элемент связан с кислородом через ионные связи. Примерами таких соединений являются оксиды натрия (Na2O), кальция (CaO) и железа (FeO).
| Свойство | Описание |
|---|---|
| Щелочность | Основные оксиды обладают щелочными свойствами, что означает, что они образуют щелочные растворы при реакции с водой. Это свойство делает их полезными в промышленности, например, для производства щелочей и моющих средств. |
| Реактивность | Основные оксиды активно реагируют с кислотами, образуя соли. Эта реакция, известная как нейтрализация, играет важную роль в химических процессах и может использоваться в различных приложениях. |
| Теплоемкость | Некоторые основные оксиды обладают высокой теплоемкостью, что делает их полезными в радиационной защите и силикатных материалах. Высокая теплоемкость позволяет им поглощать и сохранять большое количество тепла. |
| Электропроводность | Основные оксиды могут обладать электропроводностью в твердом состоянии, особенно при повышенных температурах. Это делает их полезными в различных электронных и электрохимических устройствах. |
Основные оксиды играют важную роль в понимании и применении основных принципов химии. Их свойства и реактивность помогают исследователям и инженерам создавать новые материалы и разрабатывать новые технологии для улучшения нашей жизни и окружающей среды.
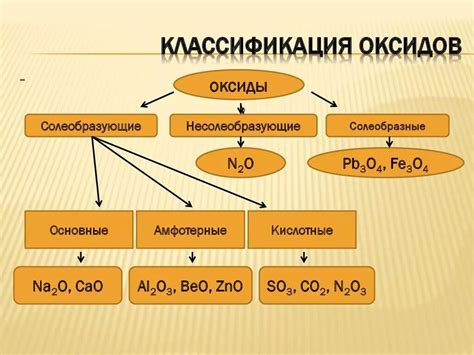
Определение основных оксидов
Основные оксиды могут быть представлены различными формулами, включающими металлические и неметаллические элементы. Например, оксид кальция имеет формулу CaO, а оксид натрия - Na2O. Важно отметить, что основные оксиды обладают свойством образовывать основания при реакции с водой.
Основные оксиды могут использоваться в промышленных процессах, в качестве поглотителей диоксида углерода в выхлопных газах или в производстве щелочей и щелочных солей. Они также играют важную роль в химическом анализе и синтезе органических соединений.
Свойства основных оксидов могут быть изменены путем введения примесей или изменения их физического состояния. Например, добавление воды к основному оксиду может привести к образованию гидроксида, а нагревание оксида может снизить его растворимость и увеличить его активность в химических реакциях.
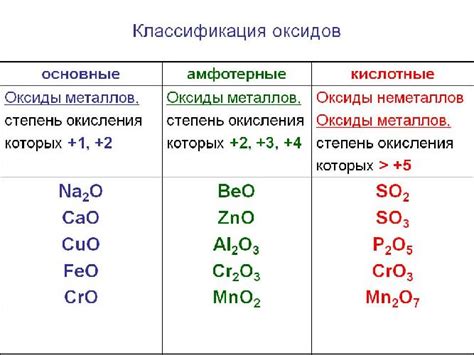
Химический состав основных оксидов
Основные оксиды в химии образуются соединением металла с кислородом. Химический состав основных оксидов можно представить общей формулой М2O, где М обозначает символ металла.
Основные оксиды являются бинарными соединениями, состоящими только из двух элементов: металла и кислорода. Их химическая формула указывает на их химический состав: две атомные единицы металла с одной атомной единицей кислорода. Некоторые примеры основных оксидов включают оксиды натрия (Na2O), кальция (CaO), магния (MgO)и алюминия (Al2O3).
Примеры основных оксидов:
- Оксид натрия (Na2O): образуется соединением двух атомных единиц натрия с одной атомной единицей кислорода. Он обладает щелочными свойствами и используется в производстве стекла и щелочных растворов.
- Оксид кальция (CaO): состоит из одной атомной единицы кальция и одной атомной единицы кислорода. Он также обладает щелочными свойствами и широко применяется в производстве цемента и железного чугуна.
- Оксид магния (MgO): состоит из одной атомной единицы магния и одной атомной единицы кислорода. Он обладает щелочными свойствами и применяется в производстве огнеупорных материалов и керамики.
- Оксид алюминия (Al2O3): образуется соединением двух атомных единиц алюминия с трех атомными единицами кислорода. Он обладает кислотными свойствами и используется в производстве алюминиевых сплавов и керамических материалов.
Химический состав основных оксидов определяет их свойства и применение в различных отраслях промышленности и науке.
Физические свойства основных оксидов

Основные оксиды обладают определенными физическими свойствами, которые обуславливают их химическую активность и применение в различных отраслях науки и промышленности. Рассмотрим основные физические свойства основных оксидов.
1. Точка плавления и кипения. Основные оксиды, как правило, обладают высокой точкой плавления и кипения. Это связано с их кристаллической структурой и взаимодействием молекул или ионов вещества.
2. Плотность. Основные оксиды обычно имеют высокую плотность из-за их компактной структуры и большой массы атомов или ионов. Это делает их тяжелыми материалами, которые могут быть использованы в различных сферах промышленности, например, в производстве конструкционных материалов.
3. Цвет. Основные оксиды могут иметь различный цвет в зависимости от состава и структуры. Некоторые из них могут быть бесцветными или светло-зелеными, в то время как другие оксиды могут иметь яркие и насыщенные цвета, такие как красный или синий. Это свойство может быть использовано в различных применениях, например, в производстве красителей или пигментов.
4. Растворимость. Основные оксиды, как правило, слабо растворимы в воде. Однако они могут растворяться в кислотах, образуя соли. Это свойство может быть использовано в химической промышленности для производства различных соединений.
5. Проводимость. Некоторые основные оксиды обладают электрической проводимостью. Это связано с наличием свободных электронов или ионов в их структуре. Это свойство может быть использовано в электротехнике и электронике для создания полупроводниковых материалов.
Описанные физические свойства основных оксидов являются лишь некоторыми из них и могут варьироваться в зависимости от конкретного вещества. Эти свойства делают основные оксиды важными соединениями с различными применениями и значением в химической науке и промышленности.
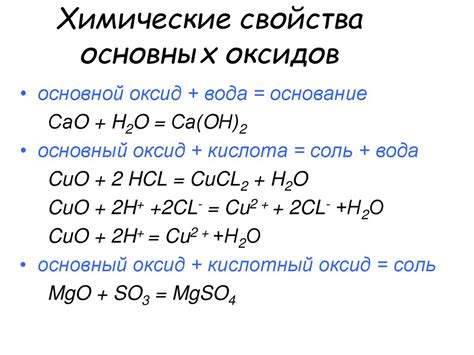
Химические свойства основных оксидов

Основные оксиды характеризуются рядом специфических химических свойств, которые определяют их роль в различных процессах и реакциях.
Первое основное свойство основных оксидов - щелочность. Эти оксиды образуют щелочные растворы при взаимодействии с водой, выделяя гидроксиды щелочных металлов. Например, оксид натрия (Na2O) реагирует с водой, образуя гидроксид натрия (NaOH). Это свойство имеет большое значение в промышленности, при производстве щелочей и других химических соединений.
Кроме того, основные оксиды проявляют амфотерность - способность реагировать и с кислотными, и с щелочными растворами. Они могут образовывать соляные соединения с кислотами и гидроксиды с щелочами. Например, оксид цинка (ZnO) может реагировать как с соляной кислотой (HCl), образуя хлорид цинка (ZnCl2), так и с гидроксидом натрия (NaOH), образуя гидроксид цинка (Zn(OH)2).
Еще одним важным свойством основных оксидов является их способность окислять вещества. Они могут вступать в реакцию с редуцированными соединениями и при этом сами претерпевать восстановление. Например, оксид железа (Fe2O3) может окислить углерод до углекислого газа (CO2), при этом сам превращаясь в металлическое железо (Fe).
Кроме того, основные оксиды обладают высокой теплопроводностью и электропроводностью. Они хорошо проводят тепло и электрический ток, что делает их важными материалами для производства электрических и тепловых устройств.
Таким образом, химические свойства основных оксидов определяют их роль в химических реакциях и процессах, а также находят применение в различных областях науки и промышленности.
Примеры основных оксидов
В химии существует множество разных основных оксидов. Некоторые из них включают:
Оксид кальция (CaO): также известный как известь, этот оксид является основным компонентом известкового камня и используется в строительстве, производстве цемента и других промышленных процессах.
Оксид натрия (Na2O): этот оксид широко используется в стекольной промышленности для производства различных типов стекла, таких как оконное стекло и посуда.
Оксид калия (K2O): этот оксид используется в качестве компонента во многих стекольных и керамических процессах. Он также является важным удобрением для растений.
Оксид магния (MgO): этот оксид используется в производстве огнеупорных материалов, таких как огнеупорные кирпичи и керамика. Он также используется в медицине в качестве антацидного препарата.
Оксид железа (Fe2O3): этот оксид широко используется в производстве красок, пигментов и косметических продуктов. Он также является основным компонентом ржавчины.
Это лишь несколько примеров основных оксидов, которые встречаются в химических процессах и промышленности. Каждый из них имеет свои уникальные свойства и применения.
Применение основных оксидов
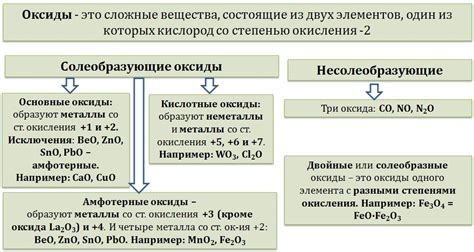
Основные оксиды широко применяются в различных областях науки и промышленности. Вот несколько примеров их применения:
1. Металлургия: Основные оксиды используются для получения металлов из руды. Например, оксид железа (Fe2O3) применяется при производстве стали.
2. Катализ: Некоторые основные оксиды, такие как оксид цинка (ZnO) и оксид кальция (CaO), используются в качестве катализаторов в химических реакциях.
3. Аграрная промышленность: Некоторые основные оксиды, например оксид калия (K2O), используются в качестве удобрений для повышения плодородия почвы.
4. Строительство: Оксид кальция (CaO), известный также как негашеная известь, используется при производстве строительных материалов, таких как цемент и штукатурка.
5. Электроника: Основные оксиды, такие как оксид натрия (Na2O) и оксид калия (K2O), применяются в производстве электронных компонентов, например стекла для ЖК-дисплеев и полупроводниковых приборов.
Это лишь некоторые примеры использования основных оксидов в различных отраслях. Их широкий спектр применения объясняется их свойствами и реакционной активностью.
Влияние основных оксидов на окружающую среду

Основные оксиды, такие как оксид натрия (Na2O), оксид кальция (CaO) и оксид калия (K2O), могут оказывать значительное влияние на окружающую среду.
Во-первых, основные оксиды могут способствовать образованию щелочных растворов при контакте с водой, что приводит к изменению pH водных систем. Это может негативно сказываться на живых организмах, так как многие они не могут выжить в слишком щелочной среде. Кроме того, подобные растворы могут способствовать разрушению инфраструктуры, материалов и почвы.
Во-вторых, основные оксиды способны образовывать атмосферные осадки, например, когда оксид серы (SO2) взаимодействует с осадками. Такие осадки могут выпадать на поверхности почвы и водоемов, вызывая их загрязнение. Это может иметь серьезные последствия для растений, животных и людей, попадающих в контакт с загрязненной средой.
Кроме того, основные оксиды могут быть причиной смога и загрязнения воздуха. При сгорании топлива оксиды азота (NOx) и оксиды серы (SOx) выделяются в атмосферу и взаимодействуют с водяными париями для образования кислотных соединений. Эти кислотные соединения затем выпадают на поверхности и вызывают загрязнение воды и почвы.
К счастью, существуют технологии и методы для минимизации влияния основных оксидов на окружающую среду. Например, можно использовать системы очистки и фильтрации на производстве, чтобы уменьшить выбросы оксидов в атмосферу. Кроме того, контрольные меры и нормативы по разрешенным концентрациям оксидов в воде и воздухе помогают снизить их негативное воздействие.



